GEN – Genetic Engineering & Biotechnology News
Doenças dos olhos que causam perda de visão e cegueira são os alvos perfeitos para novas abordagens terapêuticas.
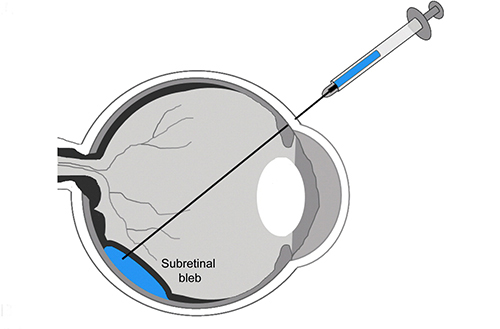
Schematic of subretinal gene therapy delivery in human patients.
Como alvo de terapia genética, a retina é um órgão particularmente bem adequado para intervenção terapêutica. A retina é um tecido pequeno, altamente compartimentado, imuno-privilegiado, e facilmente acessível. A transparência óptica do olho permite a avaliação segura da expressão do gene e efeitos terapêuticos por métodos não invasivos, tais como eletrorretinografia (ERG), fundoscopia e tomografia de coerência óptica (OCT). Esses fatores favoráveis, juntamente com um conhecimento profundo da patogênese molecular de muitas doenças da retina, o desenvolvimento e caracterização de modelos animais que imitam doenças humanas, e os avanços em ferramentas genéticas, têm proporcionado um rápido desenvolvimento de múltiplas estratégias de terapia genética para várias formas de retinopatias. Esta avaliação é focada em estratégias emergentes que utilizam terapia genética para combater a perda de visão, particularmente para o tratamento de doenças da retina causadas por mutações que afetam diretamente os fotorreceptores.
Terapia Genética de Reposição do Gene para LCA2: o primeiro sucesso
O exemplo mais bem sucedido de terapia genética ocular foi a terapia de substituição de genes RPE65, amaurose congénita de Leber 2 (LCA2), uma forma de início precoce de degeneração da retina autossômica recessiva causada por mutações no gene RPE65. Este gene codifica uma isomerase expressa principalmente no EPR que é crítico para a reciclagem do cromóforo envolvido no ciclo visual. Mutações no RPE65 podem resultar em defeito de formação do pigmento visual (ambos rodopsina e cone opsina), daí afetando gravemente a função dos fotorreceptores da visão. Grandes quantidades de apoproteínas opsina nos fotorreceptores, bem como a acumulação de ésteres de retinil tóxicos no EPR, são tidos como responsáveis pela promoção da morte progressiva de fotorreceptores. As análises do fenótipo clínico revelaram que o componente degenerativo do RPE65-LCA2 começa em uma idade precoce em pacientes com perda funcional, que é muito maior do que o esperado para a quantidade de células retidas. É esse o fenótipo que proporcionou um bom ponto de partida para uma intervenção baseada em terapia genética para esta desordem.
Vários modelos animais (ratos e cães) de LCA2 têm mostrado benefícios funcionais com terapia genética. Em particular, os resultados obtidos no RPE65 (em cão da raça Briard) que renderam profunda emoção nessa área de pesquisa devido à anatomia muito próxima do olho humano, bem como o sistema imunológico. O primeiro estudo foi realizado pela aplicação sub-retiniana do vírus adeno-associado recombinante (AAV) com 2 vetores que expressam o tipo canino RPE65 ADNc. Este estudo revelou uma melhoria dramática na função de fotorreceptores e visão nos cães tratados. Estudos subsequentes realizados com cães aumentaram a utilização de outros sorotipos de AAV, incluindo AAV1, AAV4, AAV5 e, e diferentes promotores. A melhoria da visão persistiu durante mais de 11 anos depois de uma única injeção do vetor. Além disso, a restauração bem-sucedida de ambas as funções da retina foi alcançada em 20 de 22 olhos tratados em estágio mais avançado da doença (cães com mais de 2 anos de idade).
Com base nestes estudos pré-clínicos, quatro outros estudos clínicos, separados por fases, foram iniciados e os resultados produzidos foram bastante promissores. (Dados suplementares destes estudos estão disponíveis online em www.liebertpub.com/hum). Embora os projetos destes estudos tenham variado no que diz respeito à utilização do promotor dirigindo a expressão do RPE65, o volume do vetor injetado e do protocolo cirúrgico, os dados demonstram coletivamente a segurança da atuação do AAV2 para a retina. Notavelmente, os pacientes em todos os ensaios exibiram vários aspectos de melhorias visuais dentro de alguns meses após o tratamento, embora com diferentes graus.
Estes resultados geraram entusiasmo entre os pesquisadores. O tratamento subsequente do segundo olho de pacientes LCA2, previamente tratados com o mesmo vetor, demonstrou a segurança e a eficácia da terapia, indicando que a administração sub-retiniana de AAV2 é possível, mesmo no caso de pré-existente imunidade contra o capsídeo do vetor. Estes resultados promissores justificam o início de um ensaio clínico de fase III (NCT00999609) para avaliar o tratamento de ambos os olhos em doentes com mais de 8 anos de idade. Até agora, o julgamento está confirmando as melhorias visuais anteriores: AAV2-hRPE65 deverá tornar-se o primeiro produto de terapia genética aprovado nos Estados Unidos, marcando uma etapa importante para todo a área da terapia genética. Além disso, uma fase I / II de ensaios clínicos (NCT01496040) que vai avaliar os efeitos de um vetor alternativo com maior especificidade para o EPR (AAV4-RPE65-hRPE65) foi recentemente completada.
To view the rest of this article click here.